Парадокс гигантов
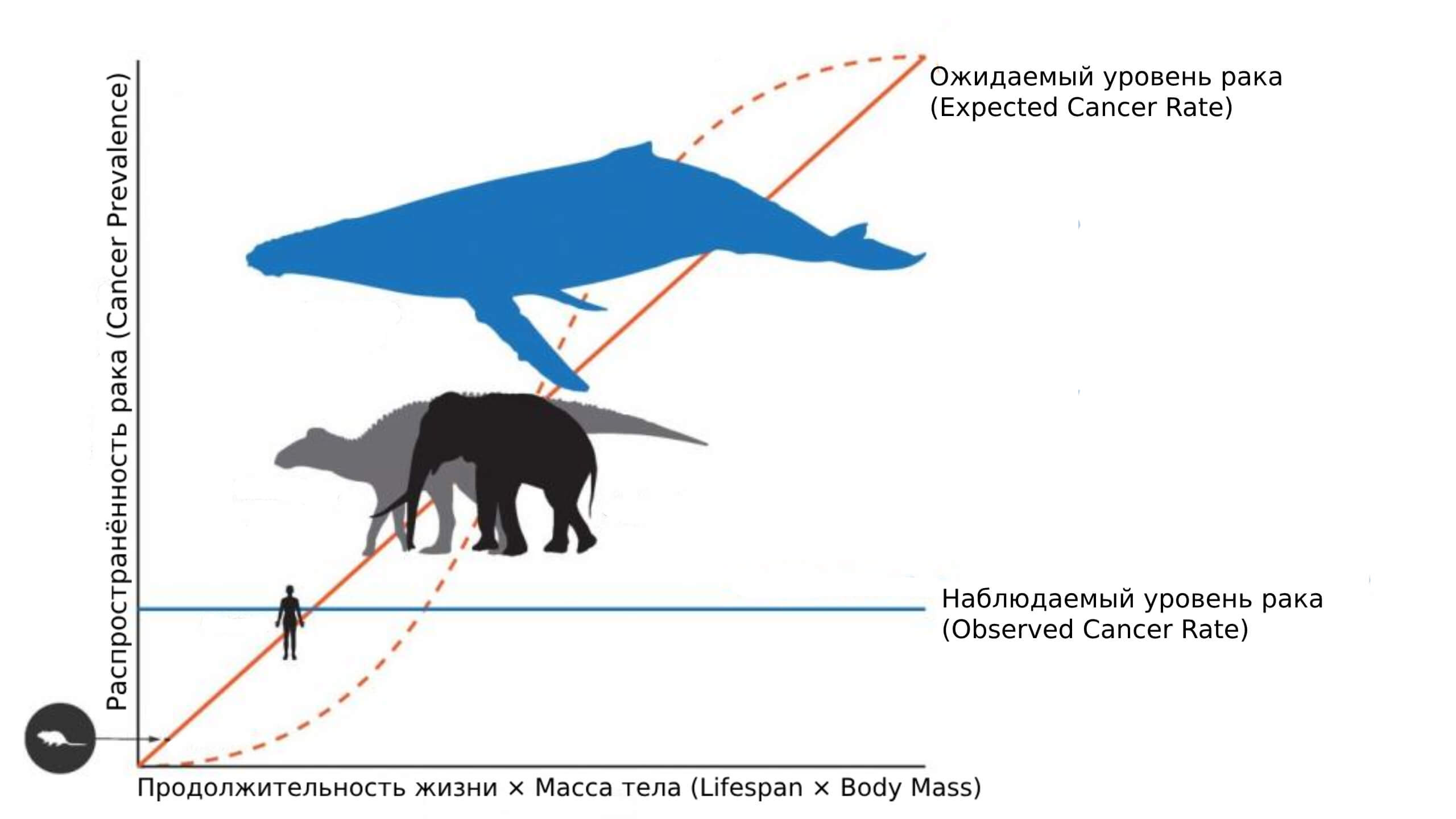
Представьте себе гренландского кита: двадцать метров длиной, почти сто тонн веса и более двухсот лет жизни под ледяной водой. Казалось бы, при таком количестве клеток и столь долгом сроке жизни риск «сбоев в системе» должен быть огромным. Ведь каждая клетка может однажды ошибиться при делении, а значит — стать началом опухоли.

Чем больше клеток и чем дольше они живут, тем выше вероятность мутаций. Казалось бы, крупные и долгоживущие животные должны болеть раком особенно часто. Но всё наоборот: киты, слоны и даже некоторые акулы страдают от рака гораздо реже, чем, например, мыши или люди.
Этот удивительный факт в 1975 году чётко сформулировал британский эпидемиолог Ричард Пето. Его наблюдение получило название парадокс Пето: почему крупные животные не умирают от рака так часто, как это предсказывает простая арифметика клеточного деления?
Клетки делятся, копируют ДНК, иногда ошибаются. Если система контроля вовремя заметила поломку — клетка останавливается, чинит ДНК или запускает саморазрушение. Если контроль не сработал, появляется опухоль.
У гигантов — миллиарды клеток и сотни лет жизни. Казалось бы, у них не должно быть шансов. Но природа не оставила их без защиты.
И тут начинается самое интересное: разные виды нашли свои, порой совершенно неожиданные способы обходить эту проблему.
Природные стратегии против рака: кто и как защищается
Если риск рака закономерно растёт с количеством клеток и числом их делений, почему у некоторых животных он остаётся низким, несмотря на гигантские размеры и долгую жизнь? Ответ на этот вопрос начинают давать сравнительные исследования разных видов, которые демонстрируют удивительную устойчивость к опухолям. Оказалось, что природа нашла не один, а несколько эффективных путей, позволяющих сдерживать рост опасных клеток.
В этом разделе мы разберём ключевые примеры таких стратегий — от многоуровневого надзора над клеточным делением у слонов до плотной гиалуроновой «брони» землекопов.
Слоны: многоуровневая система контроля с участием TP53
Один из самых известных примеров природной противораковой защиты связан со слонами. В 2015 году команда под руководством Joshua Schiffman из Университета Юты опубликовала результаты исследования, показавшего, что у африканских слонов обнаружено 20 вариантов гена TP53 — в то время как у людей всего одна. Этот ген отвечает за остановку деления повреждённых клеток и запуск их саморазрушения, если починить ДНК не удалось. Исследование

Благодаря такому усиленному контролю слоны реже сталкиваются с раком, чем можно было бы ожидать для таких крупных животных. Даже если в одной клетке произошла ошибка, система надзора вовремя её заметит и не даст развиться опухоли.
Гренландский кит: усиленная репарация ДНК и уникальные супрессоры
Гренландские киты могут жить больше 200 лет — и при этом почти не болеют раком.

В их геноме учёные нашли особые версии генов, которые отвечают за «починку» ДНК, включая усиленные формы белка PCNA, участвующего в восстановлении повреждённых участков.Исследование
Такие механизмы помогают китам исправлять мутации вовремя, несмотря на миллиарды клеточных делений за долгую жизнь.
Гренландская акула: медленный метаболизм и снижение риска мутаций
Гренландская акула — настоящий долгожитель среди позвоночных: её возраст может достигать до 400 лет.

Считается, что секрет её выносливости — в очень медленном метаболизме и редком делении клеток. Чем реже клетки делятся, тем меньше шансов на опасные ошибки в ДНК. Такой «режим замедленного движения» может помогать акулам избегать рака на протяжении столетий. Исследование
Голый землекоп: гиалуроновая броня и контактная ингибиция роста
Голый землекоп, несмотря на небольшой размер, отличается необычайным долголетием среди грызунов — до 30 лет, что значительно превышает срок жизни других животных его массы.
В 2013 году исследовательская группа Веры Горбуновой показала, что клетки землекопа выделяют высокомолекулярную гиалуроновую кислоту — примерно в пять раз длиннее, чем у других млекопитающих. Исследование
Гидры: регенерация без накопления мутаций
Гидры — небольшие пресноводные полипы, известные своей почти бесконечной способностью к регенерации. Их стволовые клетки постоянно обновляются, не давая организму стареть.
Благодаря такому постоянному «ремонту» гидры обычно избегают накопления опасных мутаций. Даже если что-то идёт не так, система обновления быстро устраняет повреждённые клетки, не давая разрастись опухолям.
Природа использует разные стратегии для защиты от рака — от усиленного контроля деления клеток до замедления обмена веществ или постоянного обновления тканей.
Птицы: редкость опухолей и возможные причины
Птицы — ещё одна загадка в истории природной защиты от рака. У многих видов опухоли встречаются реже, чем у млекопитающих похожего размера и возраста.
Почему так? Точного ответа пока нет, но есть несколько идей:
- у птиц может быть особенно эффективная иммунная система;
- их высокая температура тела (до 42 °C) и быстрый обмен веществ могут влиять на деление клеток;
- в организме активно работают белки теплового шока, которые помогают клеткам справляться со стрессом и повреждениями.
Почему нельзя просто взять их гены?
Когда учёные обнаружили у слонов аж 20 копий гена TP53, сразу возник соблазн: а что, если добавить такие же защитные гены человеку? Может, тогда рак просто не сможет появиться? Но всё оказалось гораздо сложнее.
В экспериментах на мышах попытались усилить работу p53 — белка, который останавливает деление повреждённых клеток или запускает их саморазрушение. Исследование
Результат был одновременно вдохновляющим и тревожным: опухоли действительно почти не развивались, но животные начали стареть намного быстрее. Их ткани теряли способность к восстановлению, появлялись остеопороз и мышечная слабость.
🔸 Слишком мало p53 — высокий риск рака.
🔸 Слишком много p53 — организм не может обновляться и стареет преждевременно.
Это не просто выключатель «вкл/выкл». Защита от опухолей — это тонко настроенный механизм, который работает не сам по себе, а в связке с другими процессами: делением клеток, заживлением ран, ростом тканей. Если слишком жёстко контролировать деление, пострадают не только опухоли, но и нормальные клетки, которые тоже должны время от времени обновляться.
У людей это хорошо видно на примере синдрома Ли-Фраумени — редкого наследственного заболевания. Из-за поломки в TP53 его обладатели с раннего возраста сталкиваются с множественными опухолями. Но учёные также знают и обратную крайность: чрезмерно активный p53 тоже вреден. Такой дисбаланс может привести к истощению клеточного резерва и ускоренному старению организма.
Поэтому природа решает эту задачу не количеством копий, а правильной настройкой: где, когда и насколько активно включать защитные гены. Это не жёсткий замок, а умный дозатор, который знает меру.
Именно в этом кроется причина, почему мы не можем просто скопировать стратегию слонов или китов. Их защита — часть общего архитектурного плана их биологии. А у людей, со своей динамикой роста и восстановления, слишком мощные тормоза могут сделать больше вреда, чем пользы.
Что уже пробуют в медицине?
Вместо копирования природы «один в один», учёные ищут способы адаптировать эти идеи под человеческую биологию. Вместо грубого клонирования генов кита или слона медицина делает ставку на тонкую настройку и поиск работающих аналогов.
| Трансляционная идея | Что уже сделано | Потенциал / лимиты |
|---|---|---|
| Лекарства-миметики p53 | Клинические испытания ингибиторов MDM2, которые «освобождают» p53 (Burgess et al., 2016) | Работают только если TP53 не повреждён; есть риск токсичности костного мозга |
| ДНК-ремонт à la киты | Скрининг молекул, усиливающих PCNA-зависимую репарацию (Sakurai et al., 2024) | Чрезмерный ремонт может вызвать репликативный стресс и нарушить баланс деления клеток |
| Супер-HMM гиалуронан от naked mole rat | В 2023 году введение гиалуронана землекопа продлило жизнь мышей на 10% (Zhao et al., 2023) | Сложности доставки: огромные молекулы плохо проникают в ткани, ведутся поиски новых форм |
| TP53 по-слоновьи: умный апгрейд | В 2024 г. CRISPR-эксперименты определили, какие копии TP53 у слонов критичны (Kim et al., 2024) | Массовое дублирование человеку не подходит, но точечное усиление отдельных копий перспективно для генной терапии |
Итог: Вместо жёсткого клонирования природных механизмов врачи и биологи учатся брать лучшее из защитных стратегий животных — и аккуратно встраивать эти идеи в тонкую систему человеческой регенерации и роста.
